في نهاية القرن التاسع عشر كان العلماء قد توصلوا إلى أن المادة توجد في الاشكال التالية:
- عنصر نقي
- مركب كيميائي مكون من عنصرين أو أكثر
وقد قُدمت العديد من التجارب التي تؤكد على أن هذه العناصر تتكون من ذرات وأن العنصر الواحد يتكون من نوع واحد من الذرات
فما هي الذرة؟ كان العالم ديموقرطس هو أول من افترض أن المادة تتكون من ذرات وأطلق عليها اسم (Atom) وهي كلمة يونانيّة تعني غير قابل للإنقسام . لأنه كان يعتقد أن الذرات هي أصغر الأشياء في الكون ولا يمكن تقسيمها ولكن نحن نعلم الآن أن الذرات تتكون من ثلاثة جسيمات: البروتونات والنيوترونات والإلكترونات والتي تتكون من جسيمات أصغر ، مثل الكواركات.و قد طُرحت العديد من النماذج للذرة التي قادتنا الى المفهوم الحالي ومن هذه النماذج نستعرض الاتي :
- كان أول نموذج هو (The Cannonball Atomic Model)
أي نموذج المدفع حيث تم تصور الذرة مثل كرات المدفع وهو نموذج وضعه العالم دالتون وكانت أهم بنوده:
- تتكون المادة من دقائق صغيرة غير قابلة للانقسام تسمى الذرات.
- الذرات كرات مصمتة لا تنقسم إلى أجزاء أصغر منها (تصور الذرات مثل كرات المدفع)
- العنصر الواحد يتكون من نفس النوع من الذرات والعناصر المختلفة تختلف في نوع الذرات التي تُكونها.

لاحقًا جاء كروكس وأجرى تجربته الشهيرة حيث أحضر إنبوبا زجاجيًا مفرغًا من الهواء تقريبًا ووضع في طرفيه قطعتين فلزيتين وأوصلهما ببطارية
- الجزء الموصول بالطرف السالب من البطارية يعرف بال : المهبط اوCathode
- والجزء الموصول بالطرف الموجب من البطارية يعرف بال: المصعد او Anode
وعندما قام بتمرير تيار كهربائي لاحظ خروج شعاع أخضر اللون من المهبط إلى المصعد سماها الأشعة المهبطية
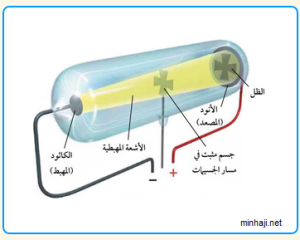
اعاد طومسون التجربة لكنه قام بتقريب مغناطيس من أنبوب كروكس حينها لاحظ تغير أتجاه الأشعة مما قاده إلى أن ما يخرج من المهبط هي جسيمات مشحونة وليست ضوءًا وعرف أن هذه الجسيمات سالبة الشحنة من ملاحظته أن التغير كان باتجاه المصعد ذي الشحنة الموجبة وسمى هذه الجسيمات بالإلكترونات.

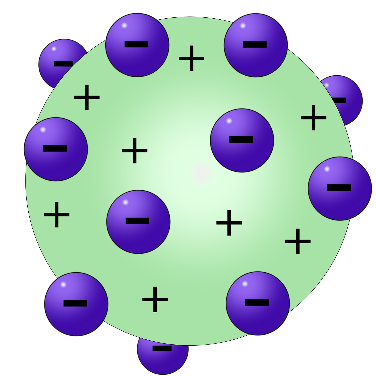
2.مما قاد طومسون إلى نموذجه النموذج الثاني Plum Pudding Atomic Model
والذي ينص على أن الذرة تتكون من مجال من المادة الموجبة وجسيمات سالبة الشحنة “الإلكترونات” تتحدد أماكنها وفقاً للقوى الكهروسكونية في المجال، وهذا يعني أن الشحنة الكلية للذرة محايدة وفقاً لنموذج طومسون.
وليكون النموذج واضحًا أكثر بإمكاننا القول أنه تصور الذرة على شكل كُرة مشحونة بكهرباء موجبة موزعةٍ بانتظام ومحشوةٍ بالإلكترونات السالبة وأن مقدار كل من الشحنة الموجبة والسالبة متساويين مما يجعل الذرة متعادلةً كهربائيًا
3. النموذج الذري الكوكبي The Planetary Atomic Model
قام العالم أرنست رذرفورد بإحضار عنصر مشع يطلق أشعة ألفا ووضع أمامه لوحًا معدنيا مغطى بكبريتيد الخارصين وفي المنتصف صفيحة رقيقة من الذهب وعندما أُطلقت أشعة ألفا وجد رذرفود أن معظم أشعة ألفا تنفذ على إستقامتها وجزءًا منها إرتد والبعض منها انحرف عن مساره.
* أما الأشعة التي نفذت فيعني أن معظم الذرة فراغ وليست كرة مصمتة كما قال دالتون وطومسون
* وأما الاشعة التي ارتدت ففسرها رذرفود ذلك بأنها قابلت شيئًا صُلبًا جعلها ترتد وهو النواة
* وأما الأشعة التي انحرفت عن مسارها فذلك يعود لوجود تنافر بين جسيمات ألفا والنواة مما يدل على أن النواة موجبة الشحنة
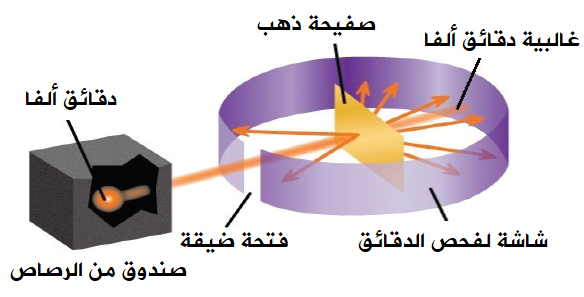
وهكذا اصبح نموذج رذرفود ينص على:
– معظم الذرة فراغ .
– توجد في الذرة نواة تقع في مركزها موجبة الشحن.
– تدور الإلكترونات حول الذرة في مدارات ثابتة.
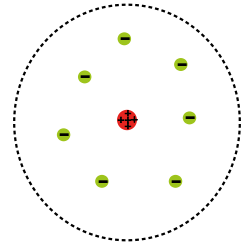
لم يستمر نموذج رذرفورد وذلك لأن الذرة ليست متوازنة مكانيكيا اي بما ان الالكترون يدور بمدار دائري فانه يفقد جزءا من طاقتة الى ان يفقدها كلها الامر الذي يؤدي الالتصاقه بالنواة وهذا الامر لايحدث في الواقع وايضا لم يستطيع تفسير الطيف الخطي.
4. نموذج بور الذري:
اقترح الفيزيائي بور نموذجًا ذريًّا معتمدًا على فرضيات رذرفورد حيث يفترض ان الالكترونات تدور حول النواة ولكنها لا تستطيع فعل ذلك الا في مدارات محددة ، و يمكن للالكترونات ان تقفز بين هذه المدارات بامتصاص الطاقة او بعثها و ذلك يعتمد على طاقة الالكترون بحيث اذا زدنا طاقته ينتقل الى مدار طاقة اعلى و يكون فرق الطاقة بين المستويين يساوي الطاقة اللتي اكتسبها الالكترون و بفترة قصيرة جدا (تقدر بجزء من مائة مليون جزء من الثانية) يطلق الالكترون الطاقة المكتسبة على شكل اشعاع ضوئي و قد اطلق بور على انتقال الالكترون من مدار الى اخر اسم قفزة الكم .
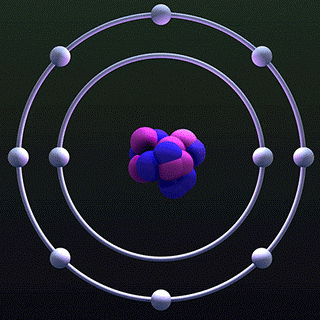
سبب نجاح هذا الفرض :استطاع ان يفسر الترددات والأطوال الموجية المحددة للطيف الخطي المنبعث من الذرات. المشكلة الرئيسية في نموذج بور هي أنه تعامل مع الإلكترونات على أنها جسيمات موجودة في مدارات محددة بدقة .
5) نموذج شرودنجر
استنادًا إلى فكرة دي بروي بأن الجسيمات يمكن أن تظهر سلوكًا موجيًا ، وضع الفيزيائي النمساوي إروين شرودنجر نظرية مفادها أن سلوك الإلكترونات داخل الذرات يمكن تفسيره من خلال معاملتها رياضيًا على أنها موجات مادة. يُعرف هذا النموذج بالنموذج الميكانيكي الكمومي أو النموذج الميكانيكي الموجي او نموذج السحابة الالكترونية. ويختلف نموذج شرودنجر عن نموذج بور في أنه لا يُعطي المسار الدقيق للإلكترون، وهو أساس الفهم الحديث للذرة . يتنبأ النموذج بالموقع المُحتمل للإلكترون اعتمادًا على دالة من الإحتمالات. وتَصف دالة الإحتمالات في الأساس منطقة مُشابهة للسحابة يُحتمل تواجد الإلكترون فيها،حيث عندما تزداد كثافة السحابة يزداد احتمال وجود الإلكترون في المنطقة و عندما تقل الكثافة يقل احتمال وجوده فيها. يُعرَّف المدار الذري بالنموذج الميكانيكي الكمومي بأنه المنطقة داخل الذرة التي تحيط بالمكان المحتمل أن يكون الإلكترون فيه 90٪ من الوقت. و ينص مبدأ اللايقين لهايزنبرغ على أننا لا نستطيع معرفة كل من طاقة الإلكترون وموقعه. لذلك عندما نعلم المزيد عن موقع الإلكترون ، فإننا نعرف القليل عن طاقته ، والعكس صحيح.و تمتلك الإلكترونات خاصية جوهرية تسمى الدوران ، ويمكن أن يكون للإلكترون إحدى قيمتي الدوران المحتملتين: الدوران لأعلى أو الدوران لأسفل و أي إلكترونين يشغلان نفس المدار يجب أن يكون لهما اتجاه دوران معاكس.


يعطيكم العافيه 💜🌸