من المعروف وجود مصطلح “مستويات الطاقة” والذي نصادفه عند دراسة الذرة وطاقة المدارات وأساسيات الهندسة النووية، ومستويات الطاقة هي مدارات وهمية لحالة ترابط بين جسيمين في ميكانيكا الكم مثل حالة الإلكترون المرتبط بالذرة ويدور حول النواة .
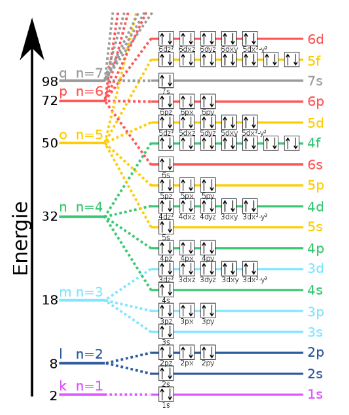
وطبقاً لنظرية الكم فإن الإلكترون يوجد فقط في حالات كمومية (مدارات) معينة أو أغلفة ذات طاقة معينة.
حسنًا, ما الذي يحدث لو قرر الإلكترون الإنتقال من مداره الى مدار أخر ؟
يوجد طريقين أمام الإلكترون ليسلكهما، الأول يتجسد في انتقال الإلكترون من مستوى طاقة أقل الى مستوى طاقة أعلى، والطريق الأخر من الأعلى الى الأقل وسنتحدث عن كل واحد منهما بالتفصيل .
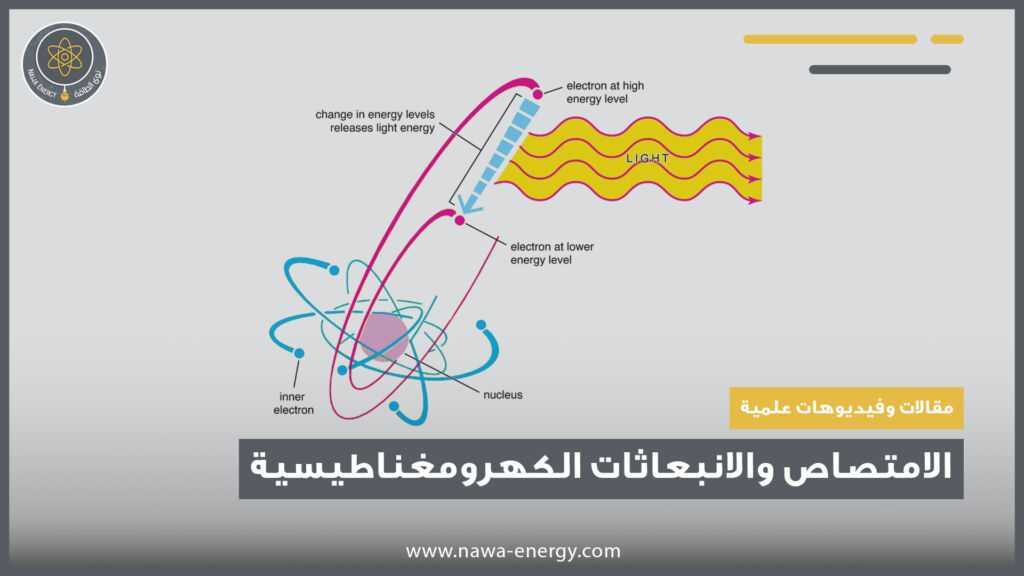
تسمى الحالة الأولى بالامتصاص الكهرومغناطيسي وهي عملية تـمتص فيها طاقة الفوتون من قبل المادة. أو بكلام أدق اكتساب أحد إلكترونات الذرة لطاقة من أحد الفوتونات. السؤال الآن هل يبقى الإلكترون في المدار الذي انتقل إليه وما الذي يحدث لو قرر الإلكترون العودة إلى مداره ؟
عند امتصاص الإلكترون فوتونًا ذا طاقة كافية لكي يغادر الإلكترون مستوى الطاقة الكمومي الذي هو فيه والإنتقال الى مستوى طاقة أعلى تصبح الذرة في حالة إثارة ولا يستطيع الإلكترون أن يبقى فيها طويلاً، فسرعان ما يطلق طاقته الزائدة في صورة فوتون (إشعاع ضوئي مثلاً) إلى الخارج، ويعود إلى مستوى الطاقة الذي كان أصلاً فيه.

الحالة الأخرى تحدث عند انتقال الإلكترون من مستوى طاقة أعلى الى مستوى طاقة أقل وتسمى بالانبعاث ولعله من الضمني حدوث الامتصاص لكي يحدث الانبعاث. لنتخذ ذرة الهيدروجين مثالاً لتبسيط ما نقول، الإلكترونات في ذرة الهيدروجين يجب أن توجد في أحد المستويات المسموح لها بالتواجد فيها، فلو أن الإلكترون في مستوى الطاقة الأول فلابُد أن يمتلك (-13.6 إلكترون فولت)، وإذا كان في مستوى الطاقة الثاني فلابد أن يمتلك ( -3.4 إلكترون فولت )، الإلكترون في ذرة الهيدروجين يُمكنه أن يمتلك ( -9 إلكترون فولت أو -8 إلكترون فولت) أو أي قيمة بينهما.
فلنفترض أن الإلكترون يريد أن ينتقل من مستوى الطاقة الأول إلى مستوى الطاقة الثاني. مستوى الطاقة الثاني طاقته أعلى من الأول، لذلك لكي ينتقل الإلكترون فإنه يحتاج اكتساب الطاقة، لكي ينتقل من المستوى الثاني للأول يجب أن يكتسب 10.2إلكترون فولت حيث (-3.4 -13.6 = 10.2 إلكترون فولت)
الإلكترون يكتسب الطاقة عن طريق امتصاص الضوء، ولكن إذا أراد الإلكترون أن ينتقل من مستوى أعلى لمستوى أقل، فيجب أن يفقد الطاقة عن طريق انبعاث الضوء، الذرة تمتص أو تبعث الضوء على هيئة حزمات منفصلة تُسمى الفوتونات، وكل فوتون له طاقة محددة، فالفوتون ذو الطاقة المٌقَّدرة بـ 2.10 إلكترون فولت فقط هو من يمكنه أن يُمتَص أو أن يَنبعث عندما ينتقل الإلكترون بين مستويي الطاقة الأول والثاني.

كيف يتم حساب طاقة الفوتون ؟
يتم حساب طاقة الفوتون من خالل القانون :
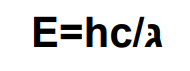
يتلو هاتان العمليتان ما يسمى ب”طيف الانبعاث الكهرومغناطيسي” وهو عبارة عن الشدة النسبية للأمواج الكهرومغناطيسية لكل تردد يتم إصداره عند تسخين هذا العنصر. فعندما تثار الإلكترونات في عنصر ما نتيجة اكتسابها للطاقة (بالتسخين مثلاً) فإنها تقفز إلى مدارات طاقة أعلى، وعندما تعود إلى المستوى الطاقة الذي بدأت منه تصدر الطاقة المكتسبة مرة أخرى على شكل شعاع ضوئي له تردد معين (فوتون). ويتم تسجيل طول موجة الأشعة الكهرومغناطيسية الصادرة عن طريق مطياف الإصدار الذري الذي يظهرها على شكل خطوط ضوئية متوازية مميزة لكل عنصر، مثلما تميز (بصمات) شخص عن شخص آخر .